Approchons-nous de la fin du cryoprécipité en Ontario?
Jeannie Callum, BA, MD, FRCPC
Directrice du Service de médecine transfusionnelle, Centre des sciences de la santé de Kingston
En octobre 2019, les résultats de l’essai FIBRES ont été simultanément publiés dans JAMA et à la séance plénière de la réunion annuelle de l’AABB1. La conduite de l’essai FIBRES a été un exploit majeur pour les technologistes des banques de sang hospitalières et les équipes de chirurgie cardiaque de 11 hôpitaux du Canada. L’essai a démontré que le concentré de fibrinogène n’était pas inférieur au cryoprécipité pour atteindre l’hémostase en cas de saignement lié à une chirurgie cardiaque et qu’il affichait un profil d’innocuité semblable. Dans l’analyse des sous-groupes, on a constaté une meilleure maîtrise des hémorragies avec le concentré de fibrinogène qu’avec le cryoprécipité chez les patients qui subissaient une intervention chirurgicale non urgente. C’était une avancée importante vers des produits sanguins à teneur réduite en agents pathogènes, transition qui avait été soutenue lors de la conférence consensuelle de Toronto sur la réduction des agents pathogènes en 20072. De fait, la Société canadienne du sang a fait avancer le Canada d’un autre pas dans ce parcours important vers la sécurité cette année (2022) avec le lancement de concentrés plaquettaires à teneur réduite en agents pathogènes.
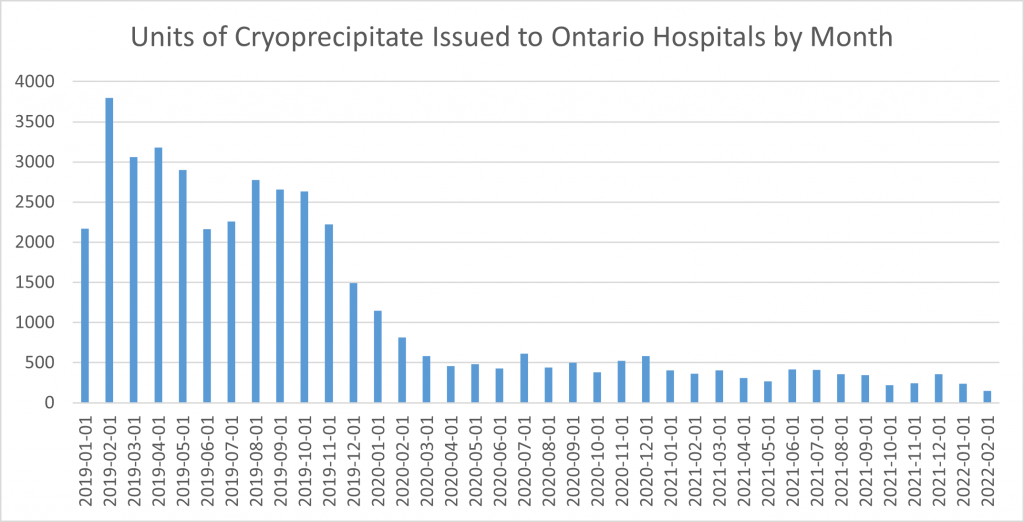
Où en sommes-nous donc, près de 30 mois après la publication de l’essai FIBRES en matière de transition vers un produit de remplacement du fibrinogène plus sûr? L’Ontario a fait volte-face après la publication de l’essai FIBRES : 8 semaines plus tard, en janvier 2020, l’émission d’unités de cryoprécipité avait déjà diminué de moitié. En février 2022, à peine 148 unités, soit approximativement 15 doses pour adultes ont été émises aux 12 hôpitaux ontariens qui continuent à en demander comme source de fibrinogène. La plupart de ces 12 hôpitaux ne sont pas des établissements d’enseignement, suggérant que la lenteur de la transition est liée au processus de changement, plutôt qu’à une croyance bien ancrée dans la supériorité du cryoprécipité. Le changement en période de COVID-19 n’est pas simple. De plus, la quasi-totalité des laboratoires de médecine transfusionnelle est aux prises avec des problèmes de personnel, liés à la pénurie de technologistes médicaux. Un petit nombre de ces 12 établissements ont aussi une clientèle pédiatrique et commandent des unités uniques, ce qui suggère une réticence à extrapoler à des enfants les données d’essais menés sur des adultes. Heureusement, deux essais randomisés comparant le cryoprécipité et le concentré de fibrinogène chez des patients pédiatriques en chirurgie cardiaque font état de résultats semblables quant à l’efficacité et à l’innocuité3,4. On peut espérer que nous donnerons en priorité aux patients pédiatriques accès à un substitut de fibrinogène plus sûr, puisque ces patients sont les plus susceptibles de vivre assez longtemps pour être affectés par un nouvel agent pathogène transmissible par le sang. Le Dr Steven Kleinman a évalué les conséquences économiques d’un nouvel agent pathogène transmis par le sang et estimé le nombre de patients qui en seraient affectés au Canada : les estimations sont effarantes5.
Outre la préoccupation majeure de sécurité liée à un produit qui peut transmettre des agents pathogènes quand un produit plus sûr est sur le marché, le cryoprécipité présente d’autres caractéristiques négatives que nous devons prendre en compte. Premièrement, la Société canadienne du sang doit collecter du sang entier (B2) pour fabriquer ce produit. Dans un article de la revue Lancet Haematology publié en 2016, Nancy Heddle s’inquiétait que le résultat pour les receveurs de ces concentrés de globules rouges appariés B2 puisse être inférieur6. Deuxièmement, quand on se sert de plasma pour fabriquer du cryoprécipité, le plasma résiduel ne peut servir ni à la transfusion, ni à la fabrication de dérivés. Troisièmement, la ligne de production B2 ne peut pas servir à la fabrication de concentrés plaquettaires. Quatrièmement, le cryoprécipité est congelé et ne peut donc pas être facilement redistribué s’il n’est pas utilisé bien avant sa date de péremption. Cinquièmement, le cryoprécipité doit être dégelé et mis en pool avant sa mise en circulation (en plus de nécessiter bien des saisies à l’ordinateur), ce qui en retarde l’émission pour les patients en hémorragie. C’est aussi une charge de travail que doit assumer notre effectif réduit de technologistes. En dernier lieu, nous n’avons aucune idée des risques pour les patients des impuretés que peut contenir le cryoprécipité (microparticules plaquettaires, facteur VIII, facteur de von Willebrand, etc.). De fait, deux articles ont soulevé la crainte d’un risque accru de complications throbo-emboliques7,8.
La Dre Judith Pool a inventé le « cryoprécipité de Pool » en 1964 pour traiter le déficit congénital en facteur VIII9. Ce produit a par la suite aussi servi au traitement de l’hypofibrinogénémie acquise10. Son emploi au cours des 60 dernières années en remplacement du fibrinogène a sans doute sauvé bien des vies, même si le produit a aussi été impliqué dans la transmission d’infections, y compris dans un cas notoire [Blood money | Maclean’s | 28 mars 1994 (macleans.ca)]. La plupart des pays d’Europe ont terminé leur transition vers les concentrés de fibrinogène11; il est rassurant de voir que l’Ontario y est presque arrivé. La plupart des pays d’Europe ont terminé leur transition vers les concentrés de fibrinogène11; il est rassurant de voir que l’Ontario y est presque arrivé.
Figure 1. Unités de cryoprécipité émises mensuellement aux hôpitaux ontariens depuis 3 ans.
Références :
- Callum J, Farkouh ME, Scales DC, Heddle NM, Crowther M, Rao V, Hucke HP, Carroll J, Grewal D, Brar S, Bussieres J, Grocott H, Harle C, Pavenski K, Rochon A, Saha T, Shepherd L, Syed S, Tran D, Wong D, Zeller M, Karkouti K, Group FR. Effect of Fibrinogen Concentrate vs Cryoprecipitate on Blood Component Transfusion After Cardiac Surgery: The FIBRES Randomized Clinical Trial. JAMA 2019;322: 1966-76.
- Webert KE, Cserti CM, Hannon J, Lin Y, Pavenski K, Pendergrast JM, Blajchman MA. Proceedings of a Consensus Conference: pathogen inactivation-making decisions about new technologies. Transfus Med Rev 2008;22: 1-34.
- Galas FR, de Almeida JP, Fukushima JT, Vincent JL, Osawa EA, Zeferino S, Camara L, Guimaraes VA, Jatene MB, Hajjar LA. Hemostatic effects of fibrinogen concentrate compared with cryoprecipitate in children after cardiac surgery: a randomized pilot trial. J Thorac Cardiovasc Surg 2014;148: 1647-55.
- Downey LA, Andrews J, Hedlin H, Kamra K, McKenzie ED, Hanley FL, Williams GD, Guzzetta NA. Fibrinogen Concentrate as an Alternative to Cryoprecipitate in a Postcardiopulmonary Transfusion Algorithm in Infants Undergoing Cardiac Surgery: A Prospective Randomized Controlled Trial. Anesth Analg 2020;130: 740-51.
- Kleinman S, Cameron C, Custer B, Busch M, Katz L, Kralj B, Matheson I, Murphy K, Preiksaitis J, Devine D. Modeling the risk of an emerging pathogen entering the Canadian blood supply. Transfusion 2010;50: 2592-606.
- Heddle NM, Arnold DM, Acker JP, Liu Y, Barty RL, Eikelboom JW, Webert KE, Hsia CC, O’Brien SF, Cook RJ. Red blood cell processing methods and in-hospital mortality: a transfusion registry cohort study. Lancet Haematol 2016;3: e246-54.
- Myers SP, Brown JB, Leeper CM, Kutcher ME, Chen X, Wade CE, Holcomb JB, Schreiber MA, Cardenas JC, Rosengart MR, Neal MD, group Ps. Early versus late venous thromboembolism: A secondary analysis of data from the PROPPR trial. Surgery 2019;166: 416-22.
- Roy A, Stanford S, Nunn S, Alves S, Sargant N, Rangarajan S, Smith EA, Bell J, Dayal S, Cecil T, Tzivanakis A, Kruzhkova I, Solomon C, Knaub S, Moran B, Mohamed F. Efficacy of fibrinogen concentrate in major abdominal surgery – A prospective, randomized, controlled study in cytoreductive surgery for pseudomyxoma peritonei. J Thromb Haemost 2020;18: 352-63.
- Swenson E, Hollenhorst MA. Dr Judith Graham Pool and the development of cryoprecipitate. Transfusion 2021;61: 1676-7.
- Callum JL, Karkouti K, Lin Y. Cryoprecipitate: the current state of knowledge. Transfus Med Rev 2009;23: 177-88.
- Nascimento B, Goodnough LT, Levy JH. Cryoprecipitate therapy. Br J Anaesth 2014;113: 922-34.
Celebrating National Nursing Week

ORBCoN celebrates National Nursing Week, many thanks to every nurse for your compassion and dedication
See you at CSTM 2022
Hope to see you at the 2022 CSTM Conference and be sure to visit ORBCoN at our booth #114 !
Friendly members of our team will be available at the booth to network and answer any transfusion medicine questions you may have.

Register: CSTM 2022 Annual Conference

Featured Resource: Bug-free Platelets video
