Pourquoi les vérifications sont-elles importantes et bénéfiques pour les laboratoires?
Sneha Patel, BMLSc, MLT, CTBS
Quality Assurance & Safety Officer
Transfusion Medicine and Tissue Bank
Sunnybrook Health Sciences Centre
Une vérification est un processus de collecte d’information systématique, indépendant, objectif et documenté. Une vérification offre des possibilités d’amélioration et permet de cerner les secteurs de risque dans les systèmes et les processus. Au sein d’une organisation, elle mesure les forces et les faiblesses par rapport aux propres procédures de l’organisation, aux normes externes volontaires et aux règlements requis tels qu’Agrément Canada Diagnostiques (ACD) et le Règlement sur le sang de Santé Canada. Les vérifications doivent être intégrées au système de gestion de la qualité (SGQ) du laboratoire.
Il existe différents types et méthodes d’évaluation applicables aux laboratoires:
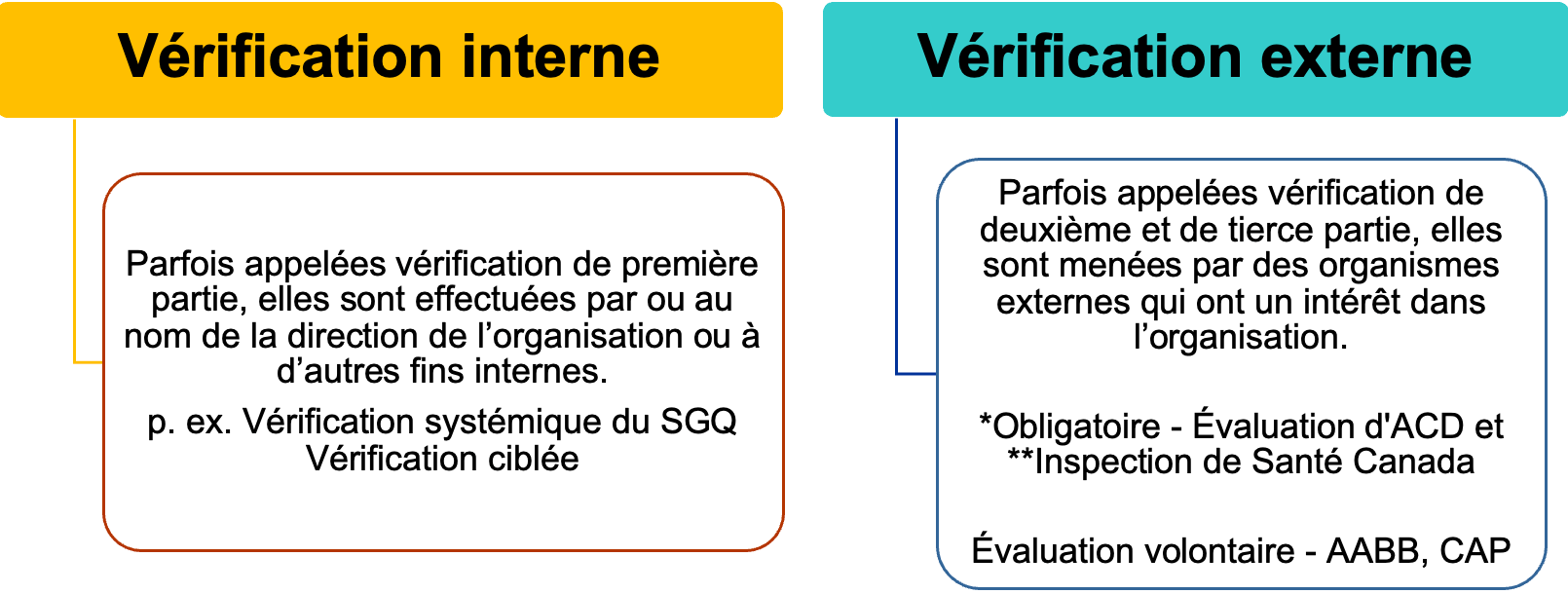
*Agrément Canada Diagnostiques (ACD) – anciennement connu sous le nom d’IQMH est obligatoire en Ontario. ACD a étendu les évaluations à certaines provinces du Canada (p. ex. la province de l’Ontario, la province du Nouveau-Brunswick, la province de Terre-Neuve-et-Labrador).
** L’inspection de Santé Canada s’applique aux laboratoires ayant un département de médecine transfusionnelle qui relèvent du Règlement sur le sang de Santé Canada.

Le type de vérification et la méthode de vérification qui correspondent à un modèle de laboratoire peuvent être déterminés en fonction de la portée des services du laboratoire, de l’accréditation et des licences. Tout laboratoire accrédité par l’ACD doit effectuer une vérification interne annuelle de son système de gestion de la qualité. En plus de l’accréditation de l’ACD, de nombreux laboratoires ayant une banque de sang, peuvent également avoir des exigences réglementaires supplémentaires en vertu du Règlement sur le sang de Santé Canada, qui exige que les banques de sang effectuent des vérifications internes au moins tous les deux ans sur toutes les activités réglementées telles que définies par le Règlement sur le sang. Certains laboratoires peuvent détenir l’accréditation d’autres organisations volontaires telles que l’« Association for the Advancement of Blood & Biotherapies » (AABB) et le « College of American Pathologists »(CAP) qui peuvent avoir leurs propres exigences de vérification. La plupart des laboratoires participent à des vérifications internes et externes. Il est très avantageux pour un laboratoire de mener périodiquement ses propres vérifications internes afin d’identifier les zones d’amélioration et de conformité aux normes et réglementations.

Une vérification peut être effectuée par du personnel qualifié ou par un vérificateur externe (tiers qualifié au nom de l’établissement; cette personne doit bien connaître l’objet de la vérification. Un vérificateur ne devrait pas vérifier son propre domaine de travail afin d’atténuer tout parti pris ou conflit d’intérêts. Surtout si une vérification est effectuée sur des activités réglementées qui relèvent du Règlement sur le sang de Santé Canada, le vérificateur ne doit pas être directement responsable des procédures ou des processus qu’il vérifie. Par exemple, un superviseur responsable de la préparation des composants ne doit pas vérifier les activités de préparation des composants menées par son propre département. Un vérificateur devrait toujours utiliser une approche fondée sur des données probantes lors de la vérification, c’est-à-dire fondée sur des éléments probants objectifs et des observations de première main.
Le succès d’une vérification interne repose sur une préparation adéquate, un rendement précis, des rapports bien documentés et perspicaces et un suivi productif après l’achèvement de la vérification interne. Il existe divers outils de vérification et de ressources sur la façon de mener une vérification. Reportez-vous à la liste des ressources disponibles à la fin de cet article pour plus d’information.
Des vérifications internes peuvent être effectuées sur toutes les activités opérationnelles du laboratoire. Voici quelques exemples d’application des vérifications internes. Les vérifications peuvent être adaptées pour répondre aux exigences des laboratoires.
Équipement de laboratoire – une vérification interne peut être effectuée pour déterminer si les procédures de laboratoire établies pour l’entretien de l’équipement sont conformes p. ex., l’entretien préventif (EP) est effectué conformément à l’horaire, au moment ou avant qu’il atteigne sa date d’échéance; les réparations et les procédures de vérification de l’équipement après une réparation sont suivies par le laboratoire; les rapports de service et d’entretien sont examinés et signés par le personnel affecté à la qualité ou à la gestion désigné, etc. Le but de la vérification est d’examiner s’il y a des lacunes relevées dans les services d’EP de l’équipement et d’assurer la conformité aux procédures relatives à l’équipement de laboratoire. The purpose of the audit is to verify if there are any gaps identified in meeting equipment PM services, and to ensure conformance to the laboratory equipment procedures.
Composants sanguins et produits sanguins – une vérification interne permettra de vérifier si la banque de sang suit ses procédures en ce qui concerne la revue et le dépistage de demandes reçues par un médecin pour des composants et/ou produits sanguins pour en déterminer la pertinence, la préparation du produit et sa délivrance ainsi que de voir si les procédures sont conformes aux politiques établies par le laboratoire et l’établissement sur l’utilisation des composants et produits sanguins.
Programme de formation et de compétences du personnel – une vérification interne permettra de déterminer si le programme de formation et de compétences est suffisant pour répondre aux normes et règlements applicables aux laboratoires. Les documents de formation et de compétences sont-ils remplis conformément aux procédures de laboratoire établies? La formation et les compétences sont des zones difficiles où l’achèvement de certaines tâches de formation dépend d’autres facteurs, ce qui conduit souvent à une documentation incomplète du dossier de formation. Par conséquent, une vérification interne périodique, en particulier sur les dossiers de formation et de compétences du personnel nouvellement recruté, est très utile pour préciser les lacunes et permet au laboratoire d’agir en temps opportun avant les évaluations ou inspections externes.
Certains points clés à considérer lors de la réalisation d’une vérification sont de s’assurer que la vérification est suivie du début jusqu’à la fin. Après la vérification, il est essentiel qu’un laboratoire prépare un résumé final des lacunes identifiées et les examine avec toutes les parties prenantes clés, y compris la haute direction. Établissez un plan de mesures correctives avec les personnes ou les membres de l’équipe responsables, ainsi qu’un échéancier pour son achèvement. Au fil du temps, il devient difficile de revenir aux lacunes de la vérification, car il peut y avoir de nombreuses vérifications en cours. Toutefois, il est impératif qu’un suivi ultime soit effectué pour s’assurer que toutes les lacunes relevées lors de chaque vérification ont été comblées en temps opportun. Le soutien de la haute direction est essentiel à l’efficacité et au succès du programme de vérification. Les données recueillies peuvent fournir des informations de gestion pour la planification future, la détermination des risques et la compréhension de l’efficacité du fonctionnement du laboratoire. En résumé, le fait d’avoir un programme solide de vérification interne s’avère très bénéfique pour cerner les lacunes, offre une occasion d’amélioration et permet de s’assurer qu’un laboratoire est prêt pour toute évaluation ou inspection externe de laboratoire à venir.
Relevant Information:
- 1. Ligne directrice : Règlement sur le sang, 2014-10-22, 94(1)(j)Système de vérification interne; https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/produits-biologiques-radiopharmaceutiques-therapies-genetiques/information-demandes-presentations/lignes-directrices/reglement-sang/ligne-directrice-reglement-s
- Clinical and Laboratory Standards Institute guideline QMS15—Laboratory Internal Audit Program, QMS15-Ed2 May 2022 – https://clsi.org/media/2jofh5wr/qms15_sample.pdf
Clinical and Laboratory Standards Institute guideline QMS15—Laboratory Internal Audit Program provides recommendations for establishing an internal audit program and related processes for enhanced quality and continual improvement in the laboratory. The audit program defines the “who,” “what,” “when,” “where,” and “how” of meeting requirements for internal auditing, and the audit process describes the details of conducting an audit. Committed laboratory leadership and individuals willing to share their expertise and experience enable a successful internal audit program. Clinical and Laboratory Standards Institute (CLSI). Laboratory Internal Audit Program. 2nd ed. CLSI guideline QMS15 (ISBN 978-1-68440-150-5; ISBN 978-1-68440-151-2 ). Clinical and Laboratory Standards Institute, USA, 2022. - Laboratory Audits: Overview, Guide, and Tips by Germans Frolovs | Feb 25, 2022 | Audits; SimplerQMS Company; https://www.simplerqms.com/laboratory-audits/
- Laboratory Internal Audit Plan, Association of Public Health Laboratories, 2017; https://www.aphl.org/aboutAPHL/publications/Documents/QS-2017May-Internal-Audit-Plan.pdf
From ORBCoN Crew
TM New Year’s Resolution
A New Year is upon us and with the New Year comes time for new beginnings. New beginnings bring to mind resolutions and TM departments are always striving to improve their services which is what resolutions are all about!
ORBCoN would like to suggest some New Year’s resolutions for your TM department. These are based on the top Accreditation Canada Diagnostic non-conformances that were noticed from the previous year
This year Transfusion Medicine resolves to:
WANT: Have a training program and competency assessment process that is evaluated for its effectiveness for all personnel involved in the administration of blood products including physicians, nurses, and laboratory personnel, that will consider the complexity of tasks and potential for error.
NEED: Equipment that have the capacity to monitor the temperature range of the contents, can be set at the acceptable temperature range for the products stored inside and have an audible alarm when temperatures go beyond the acceptable range.
SHARE: Procedures for the return of products from a clinical area that take into consideration all possible products that can be issued, not only red blood cell units.
SUCCEED: Establish a comprehensive home infusion process that includes all necessary elements such as identification of person picking-up the product, redistribution of products near expiry, safety precautions, sources of variability, and follow up for transfusion complications.
Newsboard
Tech Assessment

The Bloody Easy Technologist Assessment program is now available on the new ORBCoN Learning Management System (LMS) and Surge Learning platforms.
A communication has been issued with instructions to provide site administrator information for access to the ORBCoN LMS and guidance for current Surge Learning clients.
If you have any questions or have not received the communication please reach out to alison.wendt@sunnybrook.ca
New! Save the Dates
Transfusionists Talk: Transfusion Made Bloody Easy

More info to follow! To submit a topic or patient case, email: bertad@donna
Featured Resources
Bloody Easy 5

Patient Pamphlet: New Version
Upcoming Events
UofT TM Rounds

January 26, 2023 @12pm-1pm
Marginalized communities in trauma research by Dr. Barbara Haas