Janvier 2021

Protocole d’hémorragie massive (PHM) à la population obstétricale
Dr Robert Jee MD FRCPC
Professeur adjoint, Université d’Ottawa
Département d’anesthésiologie et médecine de la douleur
L’Hôpital d’Ottawa
L’hémorragie obstétricale est une des principales causes de mortalité maternelle, la plupart du temps en raison d’une hémorragie post-partum (HPP). Dans de nombreux cas, ces décès sont considérés comme évitables. Les changements physiologiques de la grossesse rendent cette population unique en termes de gestion des hémorragies et des transfusions. L’utérus gravide est un organe remarquablement vascularisé où le débit sanguin atteint près d’un litre par minute à terme; une hémorragie massive et une coagulopathie peuvent se développer rapidement. Une réanimation en temps utile guidée par un protocole d’hémorragie massive (PHM) est essentielle.
Il y a plusieurs éléments importants à prendre en compte pour adapter un protocole d’hémorragie massive (PHM) à la population obstétricale. Notons d’abord que les parturientes accouchent dans des conditions très variables en Ontario. Dans de nombreux centres, les unités de naissance se trouvent dans des endroits plus éloignés de l’hôpital, loin des principales salles d’opération, des unités de soins intensifs et des services d’urgence où les hémorragies massives et les transfusions sont plus fréquentes. Les grands centres peuvent avoir à prendre régulièrement en charge des victimes d’hémorragies massives et être mieux préparés à les gérer, alors que la plupart des centres où il y a moins d’accouchements verront peu souvent ce type d’événement. Il est donc essentiel de disposer d’un PHM bien connu et normalisé, qui propose une approche d’activation simplifiée afin de garantir une livraison rapide des produits sanguins.
Pour la population obstétricale, le PHM standard de l’hôpital requiert une certaine adaptation. La grossesse est une période unique en son genre du point de vue de la physiologie, ce qui inclut le passage à un état d’hypercoagulabilité. On observe une augmentation de la plupart des niveaux de facteurs de coagulation, notamment les niveaux de fibrinogène qui sont multipliés par deux à terme. Ce qui semble un taux de fibrinogène normal en dehors de la grossesse peut être un taux nettement faible pour une parturiente. Un faible niveau de fibrinogène dans le contexte d’une hémorragie peut être un marqueur de coagulopathie imminente et d’hémorragie massive. Un PHM obstétrical doit inclure des conseils pour le dépistage précoce des niveaux de fibrinogène et le maintien de niveaux > 2 g/L. Un remplacement précoce du fibrinogène doit être envisagé dans la population obstétricale, selon le protocole. Il convient de noter que la coagulopathie n’est généralement pas la cause initiale de l’hémorragie maternelle, et que le développement d’une coagulopathie est souvent multifactoriel. Diverses étiologies peuvent contribuer à la coagulopathie maternelle, notamment le décollement placentaire, l’infection ou le volume rapide associé à la réanimation en attente des produits sanguins.
Les hémorragies massives chez les parturientes sont souvent imprévues et d’installation rapide. Le personnel soignant est connu pour sa difficulté à estimer la perte de sang à l’accouchement et a tendance à sous-estimer la perte de sang réelle. La réanimation initiale exclut souvent le recours à la transfusion guidée en laboratoire, et les produits sanguins sont généralement livrés dans des proportions prédéterminées avec deux fois plus de globules rouges que de plasma. Les ppareils d’analyse au chevet de la patiente qui mesurent l’hémoglobine et le RIN peuvent aider à guider la transfusion initiale. La plupart des centres obstétriques de l’Ontario ne disposent pas d’analyseurs de coagulation sanguine (TEG ou ROTEM) pour guider la gestion des transfusions.
Il vaut la peine de reconnaître qu’un PHM obstétrical fonctionne en conjonction avec les protocoles de gestion des hémorragies post-partum. Les deux ont pour objectif commun de contrôler la source des saignements, de fournir une réanimation appropriée et d’éviter le développement d’une coagulopathie. Les unités de naissance ont mis en place des politiques qui traitent à la fois de la gestion médicale et chirurgicale de l’HPP. Celles-ci comprennent des options de traitement telles que l’utilisation d’agents utéro-toniques ou d’anti-fibrinolytiques, le réchauffement actif de la patiente et des options d’escalade chirurgicale, notamment les ballons de tamponnage utérin, la ligature de l’approvisionnement en sang utérin et l’hystérectomie si nécessaire. Un PHM obstétrical doit être envisagé dans le contexte plus large des soins aux patientes en obstétrique. Il s’agit en fin de compte d’une mesure de temporisation jusqu’à ce que la source de l’hémorragie puisse être maîtrisée et qu’une transfusion guidée par les valeurs de laboratoire puisse avoir lieu.
Lors de l’élaboration et de la mise en œuvre d’un PHM pour votre hôpital, il importe de prendre en compte les populations particulières, notamment la population obstétricale. L’adaptation du protocole à la situation et aux besoins particuliers de cette population permettra d’assurer le succès du protocole et, idéalement, d’améliorer les résultats pour les patientes.
Réservez les dates :
14 avril : 16th Annual TM Education Web Conference

30 avril : Ontario’s First Recommendations for Massive Hemorrhage Protocol Virtual Sumposium

Mise à jour du protocole d’hémorragie massive pédiatrique normalisé du RRoCS
Kimmo Murto MD1,2, Suzanne Beno MD3,4, Mark McVey MD4,5, Wendy Owens ART, B Comm6 et Lani Lieberman MD7,8
1Professeur agrégé, Université d’Ottawa, Département d’anesthésiologie et médecine de la douleur; 2Institut de recherche du Centre hospitalier pour enfants de l’Est de l’Ontario; 3Professeure agrégée, Université de Toronto, Département de pédiatrie, division de la médecine d’urgence; 4Hôpital pour enfants malades de Toronto; 5Professeur adjoint, Université de Toronto, Département d’anesthésiologie et médecine de la douleur; 6Directrice de programme, Réseau régional ontarien de coordination du sang; 7Professure adjointe, Université de Toronto, Département de médecine de laboratoire et de pathologie; 8Professure adjointe, Université de Toronto, Département de médecine de laboratoire et de pathologie;
Chez l’enfant, l’hémorragie massive est la principale cause de décès évitable en situation de trauma; au bloc opératoire, c’est la principale cause d’arrêt cardiaque1-4. Six (6) naissances vivantes sur 10 000 entraînent une demande de produit sanguin d’urgence pour un nouveau-né en hémorragie massive in utero ou pendant l’accouchement en raison de décollement placentaire ou de placenta previa et un taux de mortalité de 35 %5. Comme chez l’adulte, les taux respectifs de transfusion d’une ou de plusieurs unités de globules rouges (GR) chez des patients hospitalisés se situent autour de 15 et de 3 %6,8. Les soins prodigués aux enfants en situation d’hémorragie massive varient beaucoup, en partie à cause de l’accès limité à des protocoles d’hémorragie massive (PHM) fondés sur des données probantes, en particulier dans les établissements communautaires9. Ces soins doivent s’améliorer. C’est pourquoi le RRoCS parraine la publication à l’échelle de la province de protocoles d’hémorragie massive (PHM) chez l’adulte et l’enfant ainsi que de trousses d’outils connexes; ce lancement devrait avoir lieu en 2021. Les PHM en pédiatrie ont permis une meilleure utilisation des ressources du système, notamment l’arrivée plus rapide des produits sanguins au chevet du patient et une exposition moindre à des produits sanguins en situation de trauma. Contrairement à ce qui se passe chez les adultes, toutefois, les preuves d’avantages pour les enfants en situation de trauma ou en contexte chirurgical restent difficiles à obtenir10-14.
L’objectif de cet article, le premier d’une série de deux, est de souligner brièvement les principales mises à jour contenues dans le PHM pédiatrique standardisé parrainé par le RRoCS, qui sera bientôt publié. Le second article traitera de la « proposition de valeur » associée à la mise en œuvre d’un PHM pédiatrique, particulièrement en milieu communautaire. Le lecteur est invité à lire la trousse d’outils accompagnant le PHM qui aborde la prise en charge des enfants (≤ 12 ans et
Principales mises à jour du PHM pédiatrique
La mise en place d’un PHM pédiatrique standardisé à l’échelle de la province constitue la première étape de la disparition des variations indésirables dans les soins, en vue d’améliorer les résultats pour les patients dans tous les hôpitaux de l’Ontario. Les meilleures pratiques en matière de PHM pédiatrique ont été déterminées par un groupe de travail interdisciplinaire parrainé par le RRoCS et par le comité directeur du PHM dans les établissements de soins communautaires et tertiaires de l’Ontario. Les conseils de traitement sont basés sur des données d’observation en pédiatrie ou extrapolés à partir de la littérature pour adultes, car les données prospectives sont limitées15. Les principales recommandations du groupe de travail pédiatrique sont les suivantes :
Redéfinir les déclencheurs d’un protocole d’hémorragie massive chez les enfants : La majorité des PHM sont activés à la discrétion du médecin en fonction de divers facteurs. La définition d’hémorragie massive la plus largement acceptée et fondée sur des données probantes (40 mL/kg de produits sanguins administrés sen 24 heures)16 a été remplacée par une administration estimée/réelle de 40 mL/kg de globules rouges (GR) en trois heures, car c’est pendant cette période que la plupart des décès surviennent17,18.
Administrer les produits sanguins et les cristalloïdes selon le poids (kg) pour éviter la surcharge volémique : Les produits sanguins doivent être administrés aux enfants sur une base de mL/kg (globules rouges, plasma congelé et plaquettes à raison de 20, 10-20 et 10 mL/kg, respectivement) afin d’éviter une surcharge volémique accidentelle
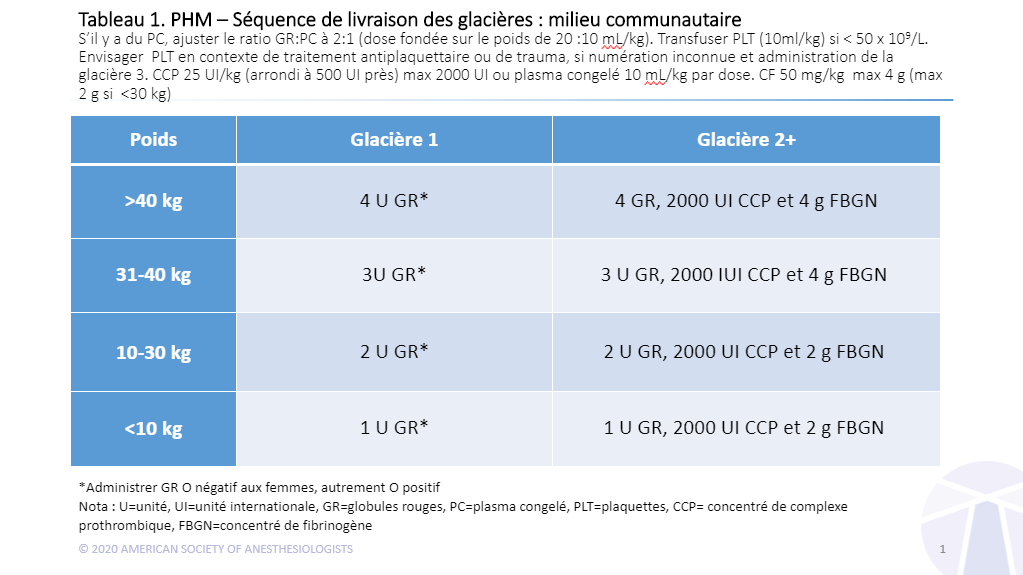
Éviter l’administration prématurée de plasma congelé : il est recommandé que la première boîte de produits sanguins administrée aux enfants, comme aux adultes, ne contienne que des globules rouges lors de la réanimation initiale dictée par un ratio).
Fonder l’administration de plaquettes sur des objectifs et non sur une formule : L’administration prophylactique de plaquettes pour réduire le risque d’hémorragie est controversée chez l’enfant33-35,43,44.
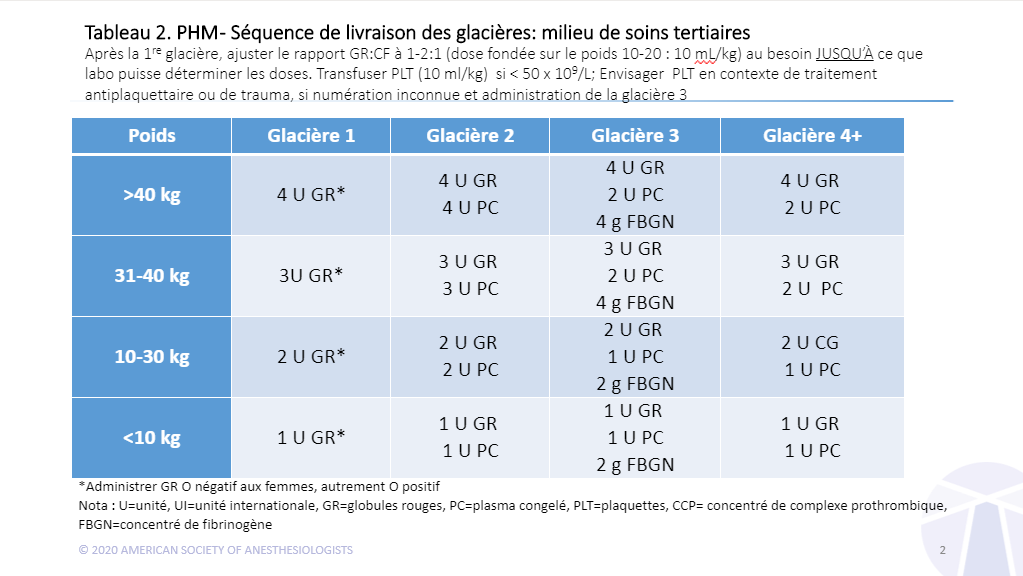
Adopter des objectifs de réanimation similaires chez les enfants et les adultes : Les seuils cibles de réanimation pédiatrique pour l’hémoglobine (≥ 80 g/L), le RIN (9/L) devraient être similaires à ceux des adultes chez la plupart des enfants de moins de 12 ans, étant donné les résultats des essais de transfusion libérale de globules rouges en milieu pédiatrique par rapport aux transfusions restreintes et les changements plus marqués dans le système de coagulation au cours des six premiers mois de vie50-56.
Éviter l’hypothermie : Compte tenu de la morbidité (c’est-à-dire risque accru de coagulopathie, d’arythmie, d’acidose et de transfusion) et de la mortalité associées à l’hypothermie chez les enfants en hémorragie, ils devraient bénéficier d’interventions visant à prévenir l’hypothermie (objectif >36 °C)60-63.
Surveiller le potassium, la glycémie et le calcium chez les enfants : L’hyperkaliémie due à une transfusion de globules rouges est, après l’hypovolémie due à une perte de sang, la cause la plus fréquente d’arrêt cardiaque en contexte périopératoire pédiatrique4. Dans la mesure du possible, les globules rouges doivent avoir moins d’une semaine ou être lavés si le patient a moins d’un an ou pèse 4.
Se rappeler que l’administration d’acide tranexamique (TXA) chez le patient pédiatrique en traumatologie n’est pas une norme de pratique : Même s’il n’existe pas encore de preuves prospectives de bénéfice ou de dommage lié à l’utilisation d’anti-fibrinolytiques comme le TXA chez l’enfant (
Entreprendre tôt le transport et la remise à un établissement de soins définitif : Les nourrissons et les enfants (75,76. La prise en charge de tels enfants dans un hôpital communautaire devrait déclencher une consultation précoce ou urgente auprès d’un service spécialisé guidée par un outil de transfert SCAR (situation, contexte, évaluation et recommandation).
Conclusion
Compte tenu de la variabilité inhérente aux PHM en pédiatrie, il est possible d’optimiser les résultats en normalisant les soins prodigués aux patients. C’est l’idéal dans un environnement souvent chaotique et lors des situations critiques qui se produisent à la fois dans les hôpitaux communautaires qui reçoivent peu de traumas et dans les hôpitaux de soins tertiaires très fréquentés. Le protocole doit tenir compte de l’immaturité de la morphologie corporelle de l’enfant et de sa petite taille, des différences mécanistes des traumas, des indications particulières qui déclenchent une transfusion plus élevée de globules rouges et de la prédisposition à l’hypothermie et à l’hyperkaliémie de l’enfant comparativement à l’adulte. Les données de substitution adulte suggèrent qu’en plus d’une amélioration des résultats pour les patients, on peut s’attendre à une réduction des complications et à des économies éventuelles77, mais dans le cadre pédiatrique, certains problèmes restent non résolus. Des données pédiatriques spécifiques plus solides sont nécessaires pour déterminer les facteurs d’activation du PHM, ainsi que les ratios de produits sanguins et le moment approprié pour la transfusion de plasma et de plaquettes, en particulier dans le cas de TCC. En outre, alors que l’acide tranexamique est bénéfique dans le cadre périopératoire non urgent, son avantage dans le cadre de traumas pédiatriques reste à déterminer. Enfin, les stratégies appropriées de gestion des fluides, des agents vasoactifs et de la douleur, ainsi que les moyens de moduler la réponse inflammatoire systémique connexe pour améliorer les résultats pour le patient restent à étudier.
Événement à venir:
Janvier 28 : “SCD: Genotyping/alloimmunization prevention and management” presented by Dr. Stella Chou.
