Mars 2021

Augmenter la pertinence des transfusions de globules rouges : l’étude START (Screening by Technologists and Auditing to Reduce Transfusion)
Amie Kron, MSc Coordonnatrice de recherche clinique, Département de médecine transfusionnelle, Centre des sciences de la santé Sunnybrook Programme de recherche transfusionnelle QUEST, Université de Toronto
Dre Jeannie Callum, MD, FRCPC Spécialiste en médecine transfusionnelle et hématologue, Centre des sciences de la santé de Kingston, Professeure au département de pathologie et de médecine moléculaire, Université Queen’s Cheffe, programme de recherche transfusionnelle QUEST, Université de Toronto, Professeure au département de médecine de laboratoire et de biopathologie, Université de Toronto Lead, QUEST transfusion research program at the University of Toronto, Professor in the Department of Laboratory Medicine and Pathobiology at the University of Toronto.
(Au nom du personnel de recherche de l’étude START)
La promotion de la conservation des produits sanguins, notamment la réduction au minimum des transfusions inutiles de globules rouges (GR), est l’un des principaux objectifs du Programme de recherche QUEST (Quality in Utilization, Education and Safety in Transfusion) de l’Université de Toronto. Environ 10 % des patients hospitalisés reçoivent une transfusion de globules rouges; une de ces transfusions sur quatre ou cinq est qualifiée d’inutile. Étant donné les risques de réactions indésirables à la transfusion, les coûts d’ensemble de cette activité, soit 700 $/unité, et l’obligation de compter sur des donneurs pour obtenir un approvisionnement sécuritaire en sang, le groupe a mené une étude d’amélioration de la qualité visant à réduire le nombre de transfusions de globules rouges inutiles.
Pour trouver des hôpitaux susceptibles de profiter d’une intervention à plusieurs volets en vue de diminuer le recours inapproprié aux globules rouges, nous avons procédé à des audits de 10 transfusions consécutives de GR par mois pendant 5 mois dans 15 grands hôpitaux, surtout communautaires. En se fiant à un ensemble de lignes directrices sur la transfusion de globules rouges, deux hématologues ont évalué indépendamment et à l’aveugle la pertinence de ces transfusions. Dans treize hôpitaux de trois provinces, la pertinence initiale était inférieure à
Le lancement des interventions s’est déroulé sur une période de trois mois. Les interventions comprenaient : 1) mise en place de lignes directrices normalisées de transfusion de GR et formation à leur sujet en ligne (p. ex. présentations PowerPoint, protecteurs d’écran, circulaires) et en personne; 2) dépistage prospectif par le LMT des ordonnances de globules rouges pendant la journée pour repérer les ordonnances inappropriées à adresser pour approbation préalable à un chef de file local dans l’établissement; et 3) audits mensuels de la pertinence des transfusions et rétroaction de l’équipe clinique. Les hôpitaux ont été soutenus pour qu’ils adoptent un seuil restrictif de transfusion chez les patients du point de vue hémodynamique — transfusion d’une seule unité à un seuil d’hémoglobine inférieur à 70 g/L ou à 80 g/L en présence de maladie cardiaque connue. Après l’intervention, un audit de 10 mois identique à l’audit initial a eu lieu; le dépistage des ordonnances de transfusions de globules rouges au LMT s’est cependant fait jour et nuit, tous les jours (24/7). La coordonnatrice centrale de l’étude a envoyé des rapports mensuels de pertinence à chaque établissement pour indiquer la proportion de leurs ordonnances de transfusion qui étaient appropriées.
La mise en œuvre de cette étude d’amélioration de la qualité a eu un impact positif sur la baisse d’utilisation des GR dans les 13 hôpitaux participants du Canada. Les audits de l’étude ont porté sur 1950 patients à qui 2877 unités de GR ont été transfusées. Avant l’intervention, 26,5 % des unités de GR transfusées avaient été qualifiées d’inappropriées. Après l’intervention, la proportion des transfusions appropriées et des transfusions d’une seule unité avait augmenté. On a aussi constaté après l’intervention une baisse des seuils d’hémoglobine justifiant une transfusion ainsi qu’une baisse du taux médian d’hémoglobine prétransfusionnelle calculé à partie de 50 unités consécutives de GR transfusées par mois (tableau 1).
Tableau 1. Résumé des résultats
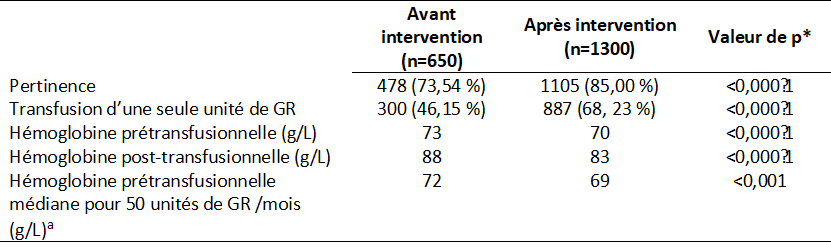
*statistiquement significatif (p<0,05) a Avant l’intervention (n=3075), après l’intervention (n=6049)
Le nombre de transfusions de GR a nettement diminué, à une baisse moyenne de 458 unités par mois. Malgré la promotion d’une approche restrictive à la transfusion, cette étude n’a eu aucune répercussion sur la sous-transfusion (hémoglobine
La mise en œuvre de cette intervention a mené à une diminution globale d’environ 5000 unités de globules rouges en 10 mois dans 13 hôpitaux. Cela se traduit par une épargne estimée de 3,1 millions de dollars. De toute évidence, les initiatives de cette étude pourraient optimiser l’utilisation du sang dans les établissements où le taux d’emploi inutile de sang est élevé. Un emploi pertinent des composants sanguins se traduit aussi par de meilleurs résultats pour les patients et pour les donneurs, tout en aidant à maintenir un approvisionnement en sang suffisant au Canada. Il faudra généraliser cette étude à l’ensemble du Canada pour aider à améliorer la gestion globale du sang dans le système de santé canadien. Grâce à Choisir avec soin Canada et à la Société canadienne du sang, une campagne d’utilisation judicieuse du sang s’appuyant sur les résultats de l’étude START a été lancée afin de réduire les transfusions inutiles de globules rouges et d’améliorer les pratiques transfusionnelles en général dans du pays.
Inscription maintenant ouverte:
April 14th: 16th Annual TM Education Web Conference

April 30th: Ontario’s First Recommendations for Massive Hemorrhage Protocol Virtual Symposium

Proposition de valeur – améliorer la qualité de la prise en charge de l’enfant en hémorragie massive
Kimmo Murto MD 1,2, Suzanne Beno MD 3,4, Mark McVey MD4,5, Wendy Owens ART, B Comm6 et Lani Lieberman MD7,8
1Professeur agrégé, Université d’Ottawa, Département d’anesthésiologie et médecine de la douleur; 2Institut de recherche du Centre hospitalier pour enfants de l’Est de l’Ontario; 3Professeure agrégée, Université de Toronto, Département de pédiatrie, division de la médecine d’urgence; 4Hôpital pour enfants malades de Toronto; 5Professeur adjoint, Université de Toronto, Département d’anesthésiologie et médecine de la douleur; 6Directrice de programme, Réseau régional ontarien de coordination du sang; 7Professure adjointe, Université de Toronto, Département de médecine de laboratoire et de pathologie; 8Réseau universitaire de santé : Hôpital général de Toronto
Voici le dernier d’une série de deux articles portant sur le protocole d’hémorragie massive chez l’enfant (PHM) parrainé par le RRoCS qui sera bientôt publié. Comme on l’a déjà dit, les PHM pédiatriques ont entraîné de meilleurs résultats liés aux procédures (p. ex. vitesse d’arrivée du produit sanguin au chevet du malade mais, contrairement à ce qu’on a vu chez les adultes, les avantages des résultats chez les enfants, tant dans un contexte de trauma que de chirurgie non urgente, restent à prouver. Le présent article cherche à résumer les aspects liés au PHM de la « proposition de valeur » en ce qui concerne l’amélioration de la qualité de prestation des services de santé en vue d’aider les administrateurs d’hôpitaux et les cliniciens à justifier la mise en œuvre d’un PHM pédiatrique malgré l’absence de résultats positifs démontrés pour les patients.
Proposition de valeur d’un PHM pédiatrique
Les systèmes de soins de santé du monde entier, y compris du Canada, commencent à passer de soins de « volume » à des soins « fondés sur la valeur »1. L’IHI (Institute for Healthcare Improvement) des États-Unis a mis au point un cadre appelé « triple objectif » (2006) pour faciliter la réforme globale des soins de santé. La Fondation canadienne pour l’amélioration des services de santé (FCASS) a adopté ce cadre en vue de procéder à une réforme globale des soins de santé. Ce cadre comprend trois objectifs interdépendants : 1. améliorer la santé des populations, 2. améliorer les soins de santé prodigués à chaque patient, y compris son expérience et 3. réduire les coûts des soins per capita2. Le système de santé actuel est financièrement insoutenable, étant donné que la croissance des dépenses en santé dépasse la croissance de l’économie3. De plus, il y a des preuves du déclin de la santé de la population et de la diminution de la qualité de la prestation des soins de santé (p. ex. accès),3,4 ce qui justifie de « brûler à l’autel » de la courbe des coûts la modification des modèles de remboursement, notamment par la responsabilisation des organismes de santé. Dans l’optique de soins de santé fondés sur la valeur, Les États-Unis ont introduit en 2010 des paramètres de rémunération au rendement fondée sur un ensemble d’incitatifs et de pénalités et faisant appel à la transparence de l’information, à la qualité des rapports, à l’informatisation clinique et à l’adoption de protocoles ou d’algorithmes éprouvés (p. ex. récupération améliorée après la chirurgie ou RAAC) afin de réduire les complications et les incidents pendant l’hospitalisation5,6,7. Les actes médicaux fondés sur la qualité (AMFQ) en pédiatrie au Canada (p. ex. amygdalectomie ou prise en charge de l’asthme) forment une tentative initiale de faire un lien entre le financement et un cycle complet de soins normalisés, y compris des résultats (p.ex. ré-hospitalisation); cependant les AMFQ sont peu nombreux et ne sont pas encore assortis des sanctions monétaires qui assureraient une certaine responsabilisation. De fait, les hôpitaux et fournisseurs de soins canadiens ne subissent que des pertes monétaires minimes résultant de dénouements négatifs pour les patients8. Récemment, de nombreux hôpitaux pédiatriques canadiens ont adhéré à des réseaux d’amélioration de la qualité en pédiatrie, notamment SPS (Solutions for Patient Safety)9 et le NSQUIP (National Surgery Quality Improvement Program)10, deux organismes américains qui prônent la mesure, la comparaison et l’amélioration des soins médicaux et chirurgicaux prodigués aux patients. Malheureusement, les soins apportés à l’enfant ou à l’adulte en hémorragie massive n’ont pas encore fait l’objet d’une telle attention 11,12,13. La trousse d’outils proposée pour accompagner le PHM est conçue pour faciliter l’atteinte de cet objectif.
La valeur de la prestation des soins de santé intègre divers aspects de l’expérience ou de la satisfaction du patient ou de la famille, la qualité, l’innocuité et le coût des soins; on l’a définie comme étant l’ensemble des résultats de santé atteints qui ont de l’importance pour les patients par rapport aux coûts engendrés pour obtenir ces résultats dans le cadre d’un cycle de traitement (voir la figure 1)14,15. Malgré les difficultés inhérentes à la mesure et à l’interprétation de la satisfaction et de l’expérience du patient16, on a suggéré que cette valeur est en corrélation avec les mesures des résultats déclarés par les patients (MRDP) que l’on peut classer en mesures des expériences déclarées par les patients (MEDP) et en mesure des dénouements déclarés par les patients (MDDP)17; on a aussi proposé une hiérarchie des MRDP à trois niveaux18. Si on l’applique à l’activation d’un PHM, cette hiérarchie pourrait capter au niveau 1, l’état de santé obtenu ou maintenu (p. ex. la survie), au niveau 2, le processus de rétablissement (p. ex. les complications immédiates ou le délai de reprise des activités normales) et au niveau 3, le maintien de la santé (p. ex. maladie provoquée par les soins liés à un produit sanguin).

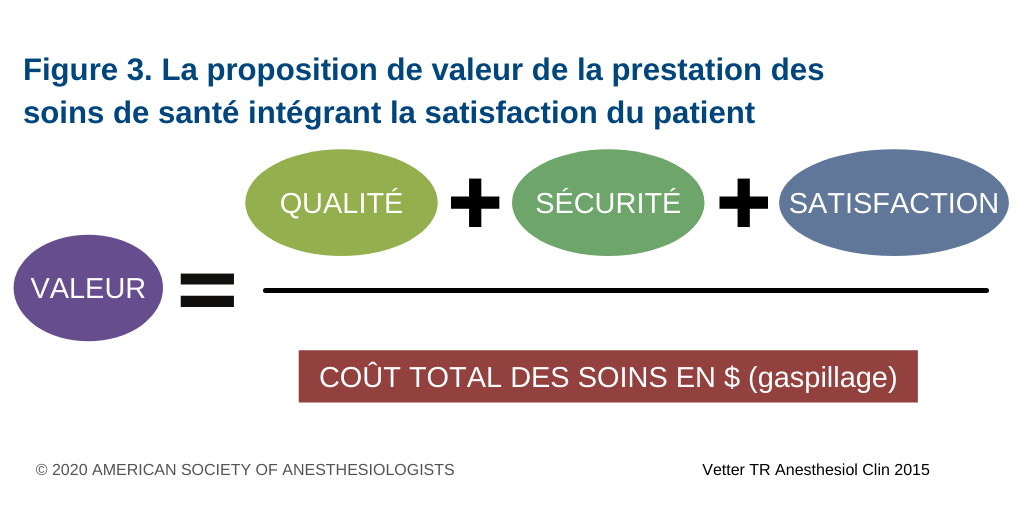
La qualité de la prestation des soins de santé. Il s’agit d’une expression souvent mal comprise. Le Virginia Mason Medical Center qui a adopté une méthode allégée « Lean ») de prestation des soins de santé recourt à plusieurs mesures de la qualité dans sa pratique quotidienne (voir la figure 2). Le mot « dénouement » (important pour le fournisseur ou le patient) est lié à des aspects d’efficacité et de sécurité, alors que le mot « service » évoque la rentabilité, la prestation en temps utile, l’équité et le fait que les soins sont centrés sur le patient. Le mot « gaspillage » de la méthode Lean fait référence aux huit (8) sources de gaspillage en santé (encadré 1). En combinant le retrait des aspects inutiles et du gaspillage dans les soins lors de l’activation d’un PHM, on multiplie d’autant les améliorations de la qualité qui permettent de réduire la variabilité globale des soins19. La figure 3 définit la proposition de valeur des soins de santé comme elle pourrait s’appliquer à un PHM pédiatrique5. Elle montre que la valeur est en corrélation directe avec la qualité, la sécurité et la satisfaction du patient et de sa famille et qu’elle est inversement proportionnelle aux coûts et au gaspillage, de sorte qu’une augmentation de la première ou une diminution de la deuxième (ou les deux) peut augmenter la valeur des soins prodigués. À cette fin, la nouvelle trousse d’outils du PHM fait la promotion de la déclaration obligatoire de huit (8) mesures de la qualité; trois paramètres de conformité au protocole seraient colligés à l’échelle provinciale (soit l’administration en temps opportun d’acide tranexamique, de GR et le passage à des transfusions de GR et de plasma spécifiques au groupe sanguin du patient); les autres – portant tant sur la procédure (p. ex. gaspillage de produit sanguin) que sur les dénouements (p. ex. survie du patient) – seraient collectés à l’échelle locale. Les mesures de qualité relatives à la sécurité des patients (p. ex. administration de produit incompatible ou hyperkaliémie subséquente au traitement restent cependant à déterminer, tout comme les résultats importants pour le patient et la famille, au-delà de la survie.


Même s’il est largement admis que la mauvaise qualité augmente les coûts, il est moins clair que l’amélioration des processus ou des résultats pour les patients réduise les coûts, le problème étant que pour améliorer la qualité, il faut parfois investir davantage (p. ex. mise à niveau des dossiers médicaux électroniques). La méthode « Lean » d’amélioration de la qualité (AQ) suggère que le fait de se concentrer au départ sur l’AQ (p. ex. réduire les soins inappropriés ou inutiles) va nécessairement entraîner par la suite une diminution des coûts de prestation des soins de santé15. Du point de vue du médecin, un projet de coupure des coûts est plus facile à accepter s’il est formulé comme une approche de réduction du gaspillage fondée sur des données fiables. Les données tirées de la littérature sur la récupération améliorée après la chirurgie (RAAC) chez l’enfant et l’adulte suggèrent qu’un protocole hospitalier normalisé fondé sur des données probantes et assorti d’éléments et d’objectifs clairement définis d’optimisation pour le patient et de diminution du stress opératoire améliore la communication interdisciplinaire, diminue la durée des hospitalisations, améliore le rétablissement, minimise les complications et permet d’économiser de l’argent6,7,20. De même, le PHM proposé par le RRoCS doit être envisagé comme une trajectoire améliorée de rétablissement après une hémorragie massive. L’ampleur des économies de coûts sera propre à chaque hôpital et dépendra de l’adhésion des dirigeants de l’établissement à la mise en œuvre d’une méthodologie d’amélioration de la qualité.
La mise en œuvre et le maintien à long terme d’un PHM en milieu clinique peuvent se révéler complexes. Malheureusement, il n’existe aucune approche fondée sur des données probantes pour assurer la réussite de la mise en œuvre d’un PHM21. Le succès repose sur la connaissance d’une démarche de gestion du changement par étapes (p. ex. la méthode de John Kotter)22. Un cadre fréquemment adopté dans des projets d’amélioration de la qualité est celui de l’amélioration continue récurrente, soit le cycle « Planifier, déployer, contrôler et améliorer (PDCA)23. Les cliniciens et le personnel de première ligne connaissent le mieux les soins aux patients et sont les mieux placés pour déterminer ce qui constitue les meilleurs soins dans leur situation clinique. Idéalement, les patients et leur famille sont représentés dans ce processus. Des exemples de mise en œuvre de PHM en milieu clinique24,25,26, révèlent qu’elle peut prendre jusqu’à 12 mois et qu’elle est habituellement entreprise par une équipe multidisciplinaire; les exemples font référence à la formation des praticiens, au besoin d’évaluation des obstacles locaux spécifiques à la mise en œuvre et surtout, à la nécessité d’appui de la part de la direction de l’établissement7,27. La trousse d’outils du PHM devrait fournir au lecteur des ressources qui permettront de cerner les obstacles à la mise en œuvre et des stratégies pour les surmonter. Une « boucle de rétroaction continue » est essentielle pour obtenir les commentaires des fournisseurs de soins, des données sur les résultats des patients, des données quantitatives sur les services (p. ex. administration de TXA) et des données particulières à l’établissement (p.ex. durée de séjour ou complications) afin d’optimiser les résultats des patients et de confirmer l’adhésion au protocole. On peut parler de réussite à l’atteinte de l’ensemble des trois objectifs d’amélioration de la qualité, d’une diminution des coûts (du gaspillage) et d’une remontée du moral des soignants de première ligne15. Les normes SQUIRE (Standards for Quality Improvement Reporting Excellence) peuvent servir à faire connaître les succès du PHM à l’interne ou dans un format savant à l’externe aux autres organismes de santé28.
Conclusion
La qualité de la prestation des soins de santé au Canada occupe de plus en plus de place chez ceux qui en assument les coûts, en particulier les divers ministères provinciaux de la Santé et les assureurs privés. Des preuves indirectes tirées de données chez les adultes suggèrent que la mise en œuvre d’un PHM pédiatrique peut améliorer les résultats chez les patients et réduire les complications en plus d’entraîner des économies éventuelles des coûts MHP. Une telle mise en œuvre devrait suivre une approche en trois étapes, comprenant planification, déploiement et maintien des changements, pour surmonter les obstacles typiques liés aux connaissances, aux attitudes et aux croyances des fournisseurs de soins. La structure du PHM pédiatrique est semblable à la version pour adulte, pour des raisons de familiarité et de facilité de mise en œuvre en milieu communautaire. Même si un projet de codification de l’activation de PHM est en cours dans les bases canadiennes de données administratives sur la santé (DAS), il serait avantageux de créer parallèlement un registre ontarien d’activation de PHM afin de valider ces cas (adultes et enfants) et de saisir des paramètres de qualité liés à la sécurité, comme le traitement de la surcharge liquidienne ou de l’hyperkaliémie chez les enfants. Comme les mesures de résultats centrés sur le patient et la famille peuvent mettre en évidence des aspects nuisibles du PHM qu’il faudrait ajuster, le sondage courant sur l’expérience de soin des patients pédiatriques en Ontario doit aussi être modifié pour saisir les mesures des résultats déclarés par les patients (MRDP) et les familles portant sur les transfusions, notamment l’administration du mauvais produit sanguin, des preuves d’identification erronée du patient avant la transfusion ou la remise d’un résumé des produits sanguins administrés à l’hôpital. L’arrivée de dossiers médicaux électroniques sophistiqués (p. ex. EPIC) permettra d’administrer des sondages électroniques après le congé du patient afin de saisir les MRDP de niveau 2 associés à la qualité de vie (p. ex. PedsQL®), alors que les DAS (p. ex. SI/Urgences) mettront en lumière les résultats de niveau 3 portant sur la prestation et l’utilisation à long terme des services de santé. L’existence d’un PHM commun deviendra probablement une exigence d’agrément des hôpitaux; c’est aussi un moyen d’assurer une norme de soins supérieure et équitable à l’échelle de la province au bénéfice des enfants en hémorragie massive.
Références:
1 Porter ME, Lee TH. From Volume to Value in Health Care The Work Begins. JAMA – J. Am. Med. Assoc. 2016;316(10):1047–8.
2 Berwick DM, Nolan TW, Whittington J. The triple aim: Care, health, and cost. Health Aff. 2008;27(3):759–69.
3 Abrams RTMK. U . S . Health Care from a Global Perspective , 2019 : Higher Spending , Worse Outcomes ? New York, NY; 2020.
4 Eric C Schneider DS. From Last to First – Could the U.S. Health Care System Become the Best in the World? N. Engl. J. Med. 2017;377(10):901–4.
5 Thomas R. Vetter KAJ. Perioperative Surgical Home: Perspective II. Anesthesiol. Clin. 2015;33(4):771–84.
6 Olle Ljungqvist, Michael Scott KCF. ‘Enhanced Recovery After Surgery A Review. JAMA Surg. 2017;152(3):292–8.
7 Rove KO, Edney JC, Brockel MA. Enhanced recovery after surgery in children : Promising, evidence-based multidisciplinary care. Pediatr. Anesth. 2018;28:482–92.
8 Ontario Ministry of Health and Long-Term Care & Provincial Council for Maternal & Child Health. Quality-Based Procedures Clinical Handbook for Paediatric Tonsillectomy and Adenoidectomy [Internet]. 2016. Available from: http://www.health.gov.on.ca/en/pro/programs/ecfa/docs/qbp_tonsil.pdf
9 Lyren A, Coffey M, Shepherd M, Lashutka N, Muething S. We Will Not Compete on Safety: How Children’s Hospitals Have Come Together to Hasten Harm Reduction. Jt. Comm. J. Qual. Patient Saf. Elsevier Inc.; 2018;44(7):377–88.
10 Bruny JL, Hall BL, Barnhart DC, Billmire DF, Dias MS, Dillon PW, et al. American college of surgeons national surgical quality improvement program pediatric: A beta phase report. J. Pediatr. Surg. 2013;48(1):74–80.
11 Livingston MH, Singh S, Merritt NH. Massive transfusion in paediatric and adolescent trauma patients: Incidence, patient profile, and outcomes prior to a massive transfusion protocol. Injury. 2014;45(9):1301–6.
12 Chin V, Cope S, Yeh CH, Thompson T, Nascimento B, Pavenski K, et al. Massive hemorrhage protocol survey: Marked variability and absent in one-third of hospitals in Ontario, Canada. Injury. 2019;50(1):46–53.
13 Kamyszek RW, Leraas HJ, Reed C, Ray CM, Nag UP, Poisson JL, et al. Massive transfusion in the pediatric population: A systematic review and summary of best-evidence practice strategies. J. Trauma Acute Care Surg. 2019;86(4):744–54.
14 Porter ME, Teisberg EO. Redefining Health Care: Creating Value-Based Competition on Results. Boston: Harvard Business School Press; 2006.
15 Toussaint JS, Berry LL. The promise of lean in health care. Mayo Clin. Proc. 2013;88(1):74–82.
16 Matthew P. Manary, William Boulding, Richard Staelin SWG. The Patient Experience and Health Outcomes. N Engl J Med. 2013;368(3):201–3.
17 Raveendran L, Koyle M, Brindle M. Developing a Value Based Approach to Outcome Reporting in Pediatric Surgery. Healthc. Pap. 2019;18(4):20–7.
18 Porter ME. What Is Value in Health Care? N Engl J Med. 2010;363(26):2477–81.
19 Reyes M, Paulus E, Hronek C, Etinger V, Hall M, Vachani J, et al. Choosing Wisely Campaign: Report Card and Achievable Benchmarks of Care for Children’s Hospitals. Hosp. Pediatr. 2017;7(11):633–41.
20 Cannesson M, Kain Z. Enhanced recovery after surgery versus perioperative surgical home: Is it all in the name? Anesth. Analg. 2014;118(5):901–2.
21 Waltz TJ, Powell BJ, Fernández ME, Abadie B, Damschroder LJ. Choosing implementation strategies to address contextual barriers: Diversity in recommendations and future directions. Implement. Sci. 2019;14(1):1–15.
22 Kotter J, Cohen D. Heart of Change. Boston: Harvard Business School Press; 2002.
23 Health Quality Ontario. Getting Started Guide: Putting Quality Standards Into Practice [Internet]. 2017. Available from: http://www.hqontario.ca/portals/0/documents/evidence/quality-standards/getting-started-guide-en.pdf
24 Hendrickson JE, Shaz BH, Pereira G, Parker PM, Jessup P, Atwell F, et al. Implementation of a pediatric trauma massive transfusion protocol: One institution’s experience. Transfusion. 2012;52(6):1228–36.
25 Cotton BA, Dossett LA, Au BK, Nunez TC, Robertson AM, Young PP. Room for (Performance) improvement: Provider-related factors associated with poor outcomes in massive transfusion. J. Trauma – Inj. Infect. Crit. Care. 2009;67(5):1004–11.
26 Nunez TC, Young PP, Holcomb JB, Cotton BA. Creation, implementation, and maturation of a massive transfusion protocol for the exsanguinating trauma patient. J. Trauma – Inj. Infect. Crit. Care. 2010;68(6):1498–505.
27 Drew JR, Pandit M. Why healthcare leadership should embrace quality improvement. BMJ. 2020;368:2015–7.
28 Ogrinc G, Davies L, Goodman D, Batalden P, Davidoff F, Stevens D. SQUIRE 2.0 (Standards for QUality Improvement Reporting Excellence): Revised publication guidelines from a detailed consensus process. BMJ Qual. Saf. 2016;25(12):986–92.
Événement à venir:
March 25th: FP Analysis, START Study Results presented by Dr. Aditi Khandelwal and Ms. Amie Kron.
