Novembre 2020

Réseau canadien de médecine transfusionnelle obstétricale et pédiatrique (RCMTOP)
Faits saillants du sondage de 2018 – Ontario
Sheena Scheuermann MLT BTech, Coordonateur Régionale de Projet, RRoCS
Le Réseau canadien de médecine transfusionnelle obstétrique et pédiatrique (RCMTOP) est un sous-comité de la société canadienne de médecine transfusionnelle (SCMT). Il a été fondé en 2017; son mandat est d’évaluer, d’analyser et de mettre en application les meilleures pratiques pédiatriques et obstétriques transfusionnelles au Canada.
Un sondage national a été envoyé aux provinces dans le but d’évaluer les pratiques nationales quant aux analyses périnatales et de fournir des commentaires et des recommandations concernant les meilleures pratiques. Le rapport pancanadien a été publié au printemps 2019. Chaque province a reçu ses propres résultats tirés du sondage; le rapport de l’Ontario est présentement analysé au RRoCS.
Le sondage a été envoyé à 156 hôpitaux et laboratoires ontariens; tous les établissements ont répondu, ce qui représente un taux de réponse provincial de 100 %. Les réponses de l’Ontario représentaient 26,9 % des réponses au pays. Ce ne sont pas tous les établissements de la province qui offrent des analyses prénatales, mais 58,33 % (91 /156 répondants) le font. Les questions portant sur les analyses prénatales ont été posées aux 91 participants qui ont affirmé en faire.
| Quel énoncé décrit les analyses liées au Rh(D) réalisées chez les patientes enceintes ou les femmes en âge de procréer dans votre laboratoire? | Ontario (N=91) | National (N=243) |
| Si un D fort ou un D plus faible est rapporté ou traité comme étant positif, aucune analyse supplémentaire n’est faite | 42.8% | 30.5% |
| Si un D plus faible que la normale est rapporté ou traité comme étant négatif, aucune analyse supplémentaire n’est faite | 2.2% | 8.6% |
| 23.1% | 21.0% | |
| Si le D est plus faible que la normale à l’analyse de routine, le test est répété avec un 2e réactif ou une autre méthode | 52.7% | 51.0% |
On a demandé aux établissements qui procèdent au titrage d’anticorps cliniquement significatifs sur place (n=35) quels anticorps étaient titrés de routine (figure 1). Parmi les 35 établissements qui procédaient au titrage sur place, la plupart (88,6 %) le font en tube par test indirect à l’antiglobuline (TIA). Treize (37,1 %) établissements ont signalé qu’ils procédaient au titrage une fois par mois jusqu’à 26 semaines de grossesse et aux deux semaines par la suite ou aux deux semaines si le résultat du titrage doublait.
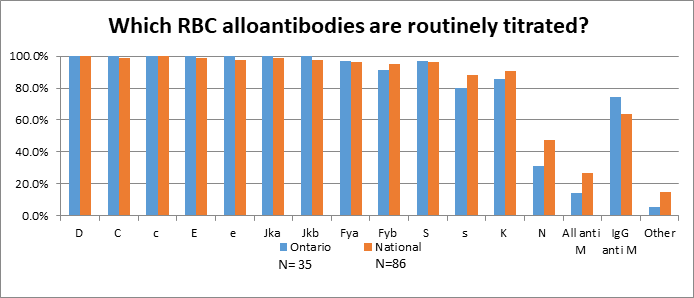
Les établissements ont répondu à une question sur les échantillons de sang de cordon. Les analyses réalisées sur le sang de cordon sont listées dans le tableau 2.
| Selon les procédures de votre service de médecine transfusionnelle, analyses qui peuvent être réalisées sur le sang de cordon | Ontario (n=95) | National (n=297) |
| ABO | 98.0% | 97.6% |
| Rh(D) | 97.0% | 97.6% |
| D faible | 91.0% | 88.2% |
| Test direct à l’antiglobuline (TDA) | 97.0% | 93.6% |
| Dépistage d’anticorps | 19.0% | 17.2% |
| Anti-A/-B maternel/passif (TIA groupage inverse) | 20.0% | 20.2% |
| Test de NaOH (ou équivalent) pour vérifier la source de l’échantillon de sang de cordon | 15.0% | 7.1% |
| Épreuve de compatibilité | 7.0% | 7.1% |
| Autre | 8.0% | 9.8% |
On a demandé aux établissements s’ils faisaient des analyses pour détecter ou quantifier les hémorragies fœto-maternelles (HFM); 48 établissements de la province ont répondu qu’ils le faisaient. La recherche initiale d’HFM se fait par analyse Kleihauer-Betke (KB) dans 46,8 % des établissements de la province (tableau 3).
| Quelle est votre méthode initiale de mise en évidence d’HFM? | Ontario (n=47) | National (n=145) |
| Rosette | 42.60% | 48.3% |
| Kleihauer-Betke (KB) | 46.80% | 45.5% |
| Cytométrie de flux s | 2.10% | 2.1% |
| Autre | 8.50% | 4.1% |
Ce sondage comportait 98 questions auxquelles on pouvait répondre de nombreuses façons en fonction des analyses faites dans un établissement donné. Nous voulons remercier le RCMTOP et la SCMT de même que tous les établissements hospitaliers qui ont participé à ce sondage. Nous avons hâte de vous présenter une analyse plus approfondie de nos résultats provinciaux l’an prochain. Pour obtenir plus d’information sur le RCMTOP, veuillez consulter le site Web de la SCMT. https://www.transfusion.ca/Ressources/Reseau-canadien-de-transfusion-obstetricale-et-ped
Administration d’IgRh : signes vitaux et surveillance du patient
Donna Berta, infirmière, BScN, coordonnatrice de projets cliniques – Soins infirmiers, RRoCS
Question : Le personnel infirmier s’interroge sur la nécessité de documenter les signes vitaux (comme on le fait quand on administre des composants sanguins, de l’IgIV ou de l’albumine) si on administre une dose de 1500 UI d’IgRh. Y a-t-il des exigences particulières quant aux signes vitaux lors de l’administration d’IgRh ou si les mêmes règles que celles en vigueur pour la transfusion d’un composant sanguin s’appliquent?
Réponse : La norme CSA Z902 – Sang et produits sanguins labiles publiée par le Groupe CSA, a été révisée en mars 2020; elle décrit en détail les exigences d’une pratique transfusionnelle sécuritaire. En ce qui concerne la transfusion de composants sanguins (globules rouges, plaquettes, plasma et cryoprécipité), les articles 11.4.15 et 11.4.16 de la norme CSA Z902-20 fournissent des directives claires : « les signes vitaux du receveur doivent être consignés au moins avant la transfusion, dans les 15 minutes qui suivent le début de la transfusion et après la transfusion. Le receveur doit demeurer en observation durant la transfusion et pour une période appropriée par la suite pour parer à l’éventualité d’un événement indésirable1 ». Pour ce qui est de la transfusion de produits sanguins (produits dérivés de sang ou de plasma humains et faits par un procédé de fabrication), l’information est moins précise. Les articles 14.1.1 et 14.1.2 de la norme CSA Z902-20 mentionne : « l’article 14 établit les exigences auxquelles sont assujettis les services transfusionnels… Il vise à harmoniser les procédures de l’établissement relatives aux produits stables avec ses procédures relatives aux produits sanguins labiles. Leur but doit être d’assurer le respect des instructions du fabricant du produit sanguin…1 ». Ailleurs (CSA Z902-20 article 14.5), on mentionne aussi : « L’exigence de traiter des mêmes aspects reconnaît que certaines exigences particulières qui s’appliquent aux produits sanguins labiles… ne peuvent pas être directement appliquées aux produits sanguins stables »1. La version courante (2017) des Normes pour services transfusionnels en milieu hospitalier, document publié par la Société canadienne de médecine transfusionnelle, ne mentionne pas d’autres directives quant aux signes vitaux ou à l’observation du patient2. Dans la monographie de WinRho® SDF (marque de IGgRh en vente en Ontario), le fabricant du produit ne précise pas qu’il faut évaluer les signes vitaux3. La monographie conseille cependant : « Après l’administration de WinRho SDF pour la prophylaxie de l’immunisation Rh, les patients doivent être en observation pendant au moins vingt minutes pour déceler l’apparition d’effets indésirables potentiels »3. Les effets indésirables éventuels sont rares; ils comprennent : réactions allergiques ou anaphylactiques (urticaire, rash, oppression thoracique, respiration sifflante, essoufflement, hypotension), inconfort ou léger gonflement au point d’injection (en cas d’administration intramusculaire) et légère augmentation de la température3. Il faut souligner que cette information tirée de la monographie de WinRhoMD SDF vaut pour une dose de 1500 UI en prophylaxie de l’immunisation Rh(D) (grossesse, complications obstétriques, transfusion de globules rouges ou de plaquettes Rh(D) positif à un patient Rh(D) négatif). Si le WinRhoMD SDF est administré comme traitement du purpura thrombocytopénique auto-immun (PTI), d’autres détails sur l’observation du patient sont décrits3.
Recommandations visant à transposer ces connaissances à la pratique clinique :
- Chaque Service de médecine transfusionnelle doit approuver la procédure de son établissement quant à la surveillance des signes vitaux et l’observation du patient au moment de l’administration d’un produit sanguin
- En cas d’administration d’IgRh en prophylaxie de l’immunisation Rd(D), la procédure doit préciser :
- Signes vitaux de base avant l’administration
Références
- Normes nationales de l’Association canadienne de normalisation. Sang et composants sanguins labiles. Toronto ON; 24 mars 2020; consulté le 9 octobre 2020. 162 p. CAN/CSA-902:20. Accès : https://community.csagroup.org/docs/DOC-126295
- Société canadienne de médecine transfusionnelle (CA). Normes pour services transfusionnels en milieu hospitalier. Markham ON; avril 2017; consulté le 9 octobre 2020. 102 p. Version 4. Accès : https://www.transfusion.ca/Ressources/Normes
- Saol Therapeutics Research Limited, distributeur (au Canada) Emergent BioSolutions Canada Inc. Monographie WINRHOMD SDF [Internet], 31 mars 2020 [consulté le 9 octobre 2020]. Accès : https://winrho.com/pdfs/WinRho%20PM-french-042420.pdf